I. Combustion de sels métalliques
Certains éléments chimiques ont la propriété, lorsqu’ils sont portés à très haute température, d’émettre un rayonnement électromagnétique caractéristique dans le domaine du visible, des ultraviolets ou de l’infrarouge. L’analyse du spectre d’émission de ce rayonnement permet d’ailleurs de conclure sur sa composition chimique.
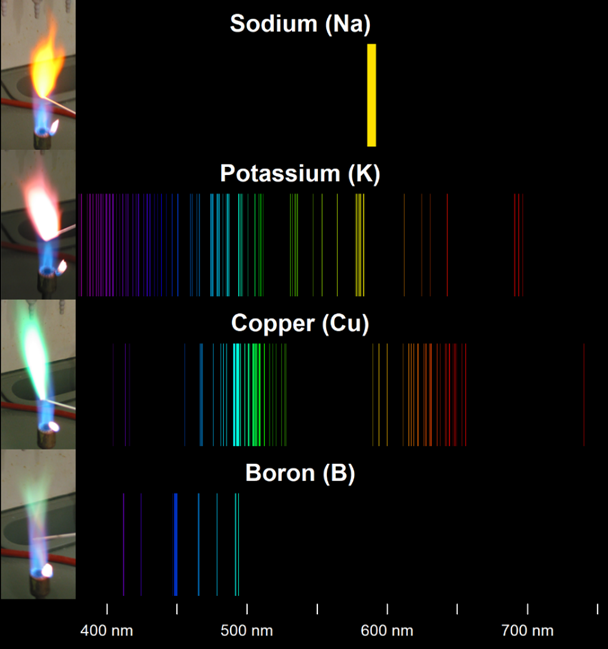

| Couleur de la flamme | Ion métallique |
| Bleue-blanche | Sn, Pb |
| Blanche | Mg, Ti, Ni, Hf, Cr, Co, Be, Al |
| Cramoisie (rouge profond) | Sr, Y, Ra, Cd |
| Rouge | Rb, Zr, Hg |
| Rose-rouge ou magenta | Li |
| Lilas ou violet pâle | K |
| Bleu azur | Se, In, Bi |
| Bleue | As, Cs, CuI, In, Pb, Tl, Ce, S |
| Bleue-verte | CuII halogéné, Zn |
| Bleue pâle-verte | P |
| Verte | CuII non-halogéné, Ta |
| Verte brillante | B |
| Verte pomme ou verte pâle | Ba |
| Verte pâle | Te, Sb |
| Jaune-verte | Mo, MnII |
| Jaune brillante | Na |
| Or ou jaune-marron | FeII |
| Orange | Sc, FeIII |
| Orange à orange-rouge | Ca |
II. Composition d’une flamme
Une flamme est le siège d’une réaction de combustion (il s’agit formellement d’une réaction d’oxydoréduction) produisant un transfert thermique (\(Q>0\)) et de la lumière sous la forme d’une émission de photons d’énergie \(h\nu\).
Il est possible de distinguer deux types de flamme :
- Les flammes de diffusion où le combustible est physiquement séparé du comburant.
- Les flammes de prémélange où les réactifs (combustible et comburant) sont déjà mélangés.
Les flammes de diffusion :
Ces flammes se rencontrent dans le plupart des combustions (combustion des solides comme le bois, combustion des liquides comme l’essence). on distingue alors plusieurs zones caractéristiques :
Le gaz combustible se trouve au centre de la flamme. La flamme en elle-même est le lieu de la réaction de combustion où les particules se retrouvent à l’état gazeux. Le comburant (dioxygène gazeux) et les produits de combustion (gaz et autres particules) se trouvent à l’extérieur de la flamme.
La flamme possède par ailleurs une forme particulière sur Terre (forme sphérique en apesanteur) sous l’action de la poussée d’Archimède des gaz chauds et de l’effet moindre de la gravitation sur les particules. Ces mouvements de convection de fluide ne permettent alors qu’une alimentation en comburant par les côtés de la flamme.
À la vue de la géométrie de la flamme, les réactions de combustion sont souvent incomplètes car elles ont lieu uniquement au niveau de l’enveloppe extérieur de la flamme. La non-stœchiométrie du rapport carburant/comburant induit donc la formation d’autres espèces chimiques (autres que la simple formation d’eau \(H_2O\) et de dioxyde de carbone \(CO_2\)) tels que du monoxyde de carbone \(CO\), de la suie (carbone \(C\)) et des gaz imbrûlés. En effet, la haute température atteinte au niveau de la flamme entraîne souvent la formation d’oxydes d’azote \(N_xO_y\) par oxydation des substances azotées par le dioxygène gazeux \(O_{2\ (g)}\).
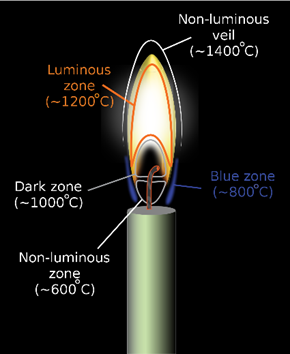
Différentes zones apparaissent visuellement lorsque l’on regarde une flamme de diffusion comme celle produite par une bougie (cire de paraffine solide \(C_nH_{2n+2}\) avec \(n\in[20;40]\)).
- Zone non-lumineuse (\(T=600\ °C\)) : dans cette zone, la paraffine liquide (présence de paraffine liquide sous la flamme) se vaporise en paraffine gazeuse selon la transformation physique : \(C_nH_{2n+2\ (l)}=C_nH_{2n+2\ (g)}\).
- Zone bleue (\(T=800\ °C\)) : des radicaux libres ((\(CH_3\bullet\)), \(C_nH_{2n+1}\bullet\)) se forment sous l’effet de la température puis se recombinent de temps à autre selon la réaction : \(C_nH_{2n+1}\bullet+C_mH_{2m+1}\bullet=C_{n+m}H_{2n+2m+2}\) libérant de la sorte un surplus d’énergie sous la forme de photons (d’où apparition d’une lumière bleue). D’autres voies de réaction sont envisageables, impliquant notamment d’autres espèces présentes dans le milieu réactionnel mais ne seront pas détaillées ici.
- Zone sombre : dans cette zone, la température avoisine \(1\ 000\ °C\) et la rareté de dioxygène entraîne la formation de suie par pyrolyse de l’excès de combustible. Ceci engendre une diminution de la luminosité par création d’une suspension de suie.
- Zone lumineuse (\(T=1\ 200\ °C\)) : la pyrolyse se poursuit et crée de plus grosses particules de suie par combustion incomplète. Ces particules se retrouvent alors en incandescence et émettent une lumière blanche-jaune au centre (lumière blanche à \(1\ 500\ °C\)) par le modèle du rayonnement du corps noir) et orangée dans les parties inférieures et haute de la flamme (entre \(700\ °C\) et \(1\ 000\ °C\)).
- Voile non-lumineux : dans cette partie de la flamme, le combustible gazeux et le dioxygène sont intimement mélangés, permettant dès lors une combustion complète selon la réaction (pour la paraffine solide) : \(C_nH_{2n+2\ (g)}+\frac{(3n+1)}{2}\ O_{2\ (g)}=n\ CO_{2\ (g)}+(n+1)\ H_2O_{(g)}\).
Les flammes de prémélange
Ces flammes sont rencontrées lorsque le combustible et le comburant sont intimement mélangés avant que la combustion ne se déroule (bec Bunsen, bec Meker, chalumeau, explosion de gaz).

La flamme est alors une mince couche de gaz séparant le mélange combustible/comburant (se dégageant à une certaine vitesse du dispositif) des produits de combustion.

Cet article est mis à disposition selon les termes de la Licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Pas de Modification 4.0 International.