Des interactions de plus faible énergie que les liaisons covalentes (mise en commun de deux électrons entre deux atomes) ou les liaisons métalliques (mise en commun d’électrons dans un réseau de cations métalliques) sont fréquemment rencontrées au sein des espèces chimiques.
La compréhension de ces interactions dites faibles est primordiale pour interpréter l’existence des différents états de la matière ou les anomalies de changement d’état par exemple.
1. Les interactions avec une charge
a. L’interaction ion-ion
Deux ions (ou plus généralement deux charges électriques) sont en interaction électrostatique (appelée aussi interaction coulombienne).
Cette interaction est attractive si les ions sont de charges opposées, répulsives si les ion sont de même charge.

L’énergie \(E_{i-i}\) associée à cette interaction s’exprime : \(E_{i-i}=\frac{z_1z_2e^2}{4\pi\epsilon_0\epsilon_rr}\)
\(z_i\) : charge de l’ion \(i\)
\(e\) : charge élémentaire, \(e=1,602.10^{-19}\ C\)
\(\epsilon_0\) : permittivité du vide, \(\epsilon_0=8,854.10^{-12}\ C^2.J^{-1}.m^{-1}\)
\(\epsilon_r\) : permittivité relative du milieu (ou constante diélectrique)
\(r\) : distance entre les deux espèces chimiques en \(m\)
b. L’interaction ion-dipôle
Un ion peut interagir avec un dipôle de moment dipolaire \(\vec{\mu}\).
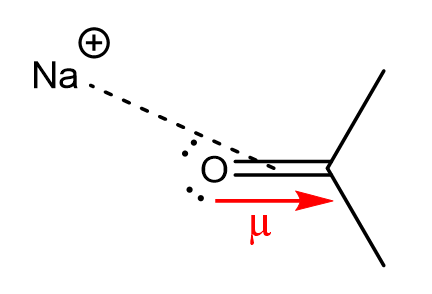
L’énergie \(E_{i-d}\) associée à cette interaction s’exprime : \(E_{i-d}=-\frac{(ze)^2\mu^2}{6(4\pi\epsilon_0\epsilon_r)^2k_BTr^4}\)
\(z\) : charge de l’ion
\(e\) : charge élémentaire, \(e=1,602.10^{-19}\ C\)
\(\mu\) : norme du moment dipolaire \(\vec{\mu}\) exprimée en \(C.m\)
\(\epsilon_0\) : permittivité du vide, \(\epsilon_0=8,854.10^{-12}\ C^2.J^{-1}.m^{-1}\)
\(\epsilon_r\) : permittivité relative du milieu (ou constante diélectrique)
\(k_B\) : constante de Boltzmann, \(k_B=1,38.10^{-23}\ J.K^{-1}\)
\(T\) : température en \(K\)
\(r\) : distance entre les deux espèces chimiques en \(m\)
c. L’interaction ion-dipôle induit
Un ion (par la présence de sa charge électrique) va polariser la matière par création d’un champ électrique \(\vec{E}\). Ce champ électrique peut être perçu par une seconde espèce chimique de polarisabilité \(\alpha\), créant par induction un moment dipolaire induit \(\vec{\mu_{induit}}\) selon la relation : \(\vec{\mu_{induit}}=\alpha\vec{E}\)
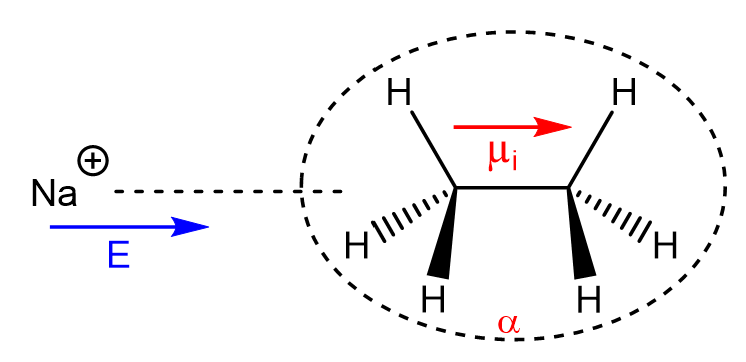
L’énergie \(E_{i-di}\) associée à cette interaction s’exprime : \(E_{i-di}=-\frac{(ze)^2\alpha}{2(4\pi\epsilon_0)^2r^4}\)
\(z\) : charge de l’ion
\(e\) : charge élémentaire, \(e=1,602.10^{-19}\ C\)
\(\alpha\) : polarisabilité en \(C.m^2.V^{-1}\)
\(\epsilon_0\) : permittivité du vide, \(\epsilon_0=8,854.10^{-12}\ C^2.J^{-1}.m^{-1}\)
\(r\) : distance entre les deux espèces chimiques en \(m\)
2. Les interactions de van der Waals
a. Interaction entre deux dipôles permanents : interaction de Keesom (1912)
Deux molécules polaires interagissent entre elles via l’interaction de Keesom. Leurs moments dipolaires \(\vec{\mu_i}\) tendent à s’aligner dans le but de minimiser l’énergie du système.

L’énergie \(E_{Keesom}\) associée à cette interaction s’exprime : \(E_{Keesom}=-\frac{(\mu_1\mu_2)^2}{3(4\pi\epsilon_0)^2k_BTr^6}\)
\(\mu_i\) : norme du moment dipolaire de l’espèce \(i\) exprimée en \(C.m\)
\(\epsilon_0\) : permittivité du vide, \(\epsilon_0=8,854.10^{-12}\ C^2.J^{-1}.m^{-1}\)
\(k_B\) : constante de Boltzmann, \(k_B=1,38.10^{-23}\ J.K^{-1}\)
\(T\) : température en \(K\)
\(r\) : distance entre les deux espèces chimiques en \(m\)
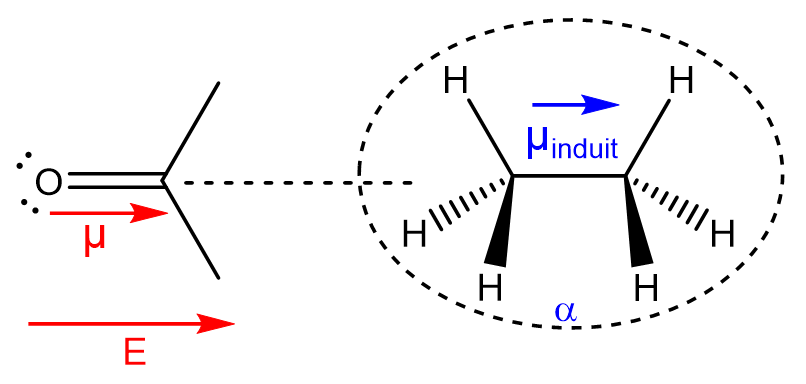
b. Interaction entre un dipôle permanent et un dipôle induit : interaction de Debye (1920)
Une molécule polaire (possédant un moment dipolaire permanent \(\vec{\mu}\)) crée à son voisinage un champ électrique \(\vec{E}\). Une seconde espèce chimique (de polarisabilité \(\alpha\)) va alors ressentir ce champ et verra sa distribution électronique par induction via l’apparition d’un moment dipolaire induit \(\vec{\mu_i}\) selon la relation : \(\vec{\mu_i}=\alpha\vec{E}\)
Entre une molécule polaire et une molécule apolaire : \(E_{Debye}=-\frac{\mu^2\alpha}{(4\pi\epsilon_0)^2r^6}\)
Entre deux molécules polaires : \(E_{Debye}=-\frac{\mu_1^2\alpha_2+\mu_2^2\alpha_1}{(4\pi\epsilon_0)^2r^6}\)
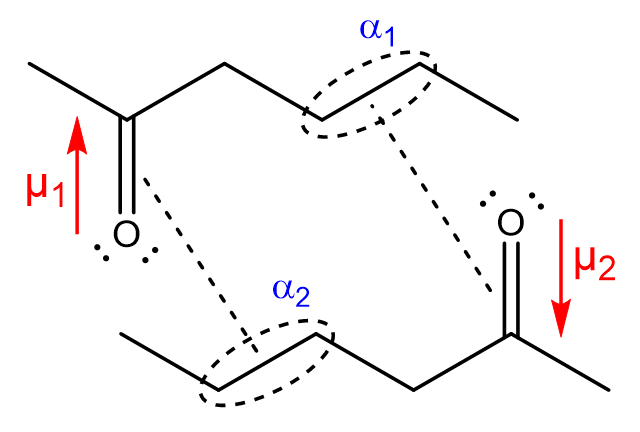
\(\mu\) : norme du moment dipolaire de exprimée en \(C.m\)
\(\alpha\) : polarisabilité en \(C.m^2.V^{-1}\)
\(\epsilon_0\) : permittivité du vide, \(\epsilon_0=8,854.10^{-12}\ C^2.J^{-1}.m^{-1}\)
\(r\) : distance entre les deux espèces chimiques en \(m\)
c. Interaction entre deux dipôles induits : interaction de London (1930)
La fluctuation de la position instantanée des électrons au sein d’une espèce au cours du temps crée un moment dipolaire instantané non nul (bien que sa moyenne temporelle soit nulle). Ce moment dipolaire induit peut alors polariser une seconde espèce chimique de polarisabilité \(\alpha\). Ceci va alors créer une interaction dite de London aussi connue sous le nom d’interaction de dispersion.
L’interaction de London peut aussi se faire avec des espèces polaires.
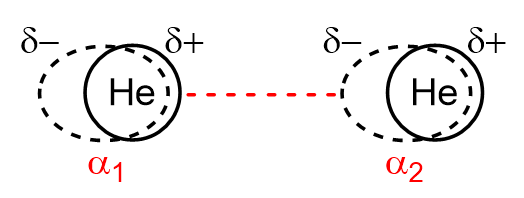
L’énergie \(E_{London}\) associée à cette interaction s’exprime : \(E_{London}=-\frac{3}{2}\frac{EI_1EI_2}{EI_1+EI_2}\frac{\alpha_1\alpha_2}{(4\pi\epsilon_0\epsilon_r)^2r^6}\)
\(EI_i\) : énergie de première ionisation de l’espèce \(i\)
\(\alpha\) : polarisabilité en \(C.m^2.V^{-1}\)
\(\epsilon_0\) : permittivité du vide, \(\epsilon_0=8,854.10^{-12}\ C^2.J^{-1}.m^{-1}\)
\(r\) : distance entre les deux espèces chimiques en \(m\)
En résumé, il est nécessaire de prendre en compte les trois contributions des interactions de van der Waals.
\(E_{vdW}=-\frac{constante_{Keesom}}{r^6}-\frac{constante_{Debye}}{r^6}-\frac{constante_{London}}{r^6}=-\frac{constante_{vdW}}{r^6}\).
Pour les molécules très polaires, c’est l’interaction de Keesom qui prédomine.
Pour toutes les autres molécules, c’est l’interaction de London qui prédomine.
3. La répulsion de Pauli
Les interactions faibles ont tendance à rapprocher les espèces chimiques entre elles néanmoins il apparaît à très courte distance une force de répulsion dite de Pauli due à la non-pénétration des nuages électroniques.
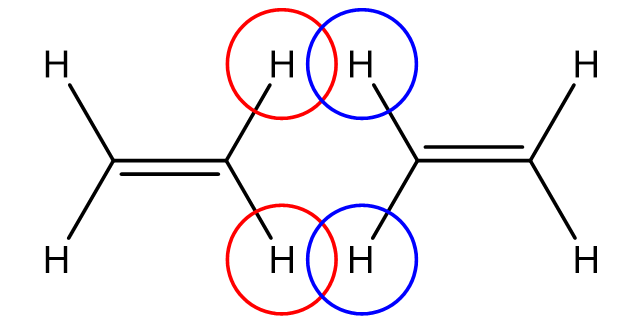
L’énergie \(E_{répulsion}\) associée à cette interaction s’exprime : \(E_{répulsion}=\frac{constante}{r^{12}}\)
4. La liaison hydrogène
Il peut s’établir au sein de la matière des liaisons hydrogène lorsque l’enchaînement suivant est observé :
\(Atome\ électronégatif-H\cdots Doublet\ non\ liant\)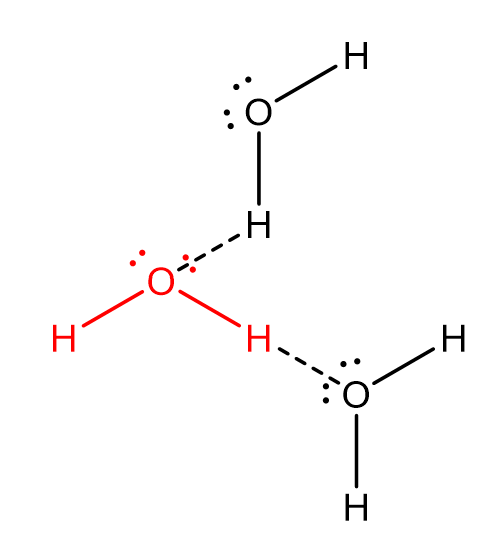
Il s’agit d’une interaction directive où les trois atomes sont alignés.
La liaison hydrogène est environ deux fois plus longue qu’une liaison covalente et possède une énergie d’environ \(10\ kJ.mol^{-1}\).
5. Vers d’autres types de liaisons faibles
On peut citer d’autres types d’interaction faible :
- Liaison halogène : \(Atome\ électronégatif-X\cdots Doublet\ non\ liant\) entre \(5\ et\ 180\ kJ.mol^{-1}\)
- Interactions avec les système \(\pi\).
Interaction métal-pi (entre un métal et un système pi)
Interaction polaire-pi (entre un molécule polaire et un système pi)
Interaction pi-pi (entre deux système pi)
Interaction cation-pi
Interaction anion-pi
Interaction pi donneur-accepteur (entre un système pi riche en électrons et un système pi pauvre en électrons)
Interaction C-H-pi (entre une liaison C-H et un système pi)
Vous pourrez rencontrer dans votre cursus d’autres types de liaisons (3c-2e, 3c-4e, 4c-2e, liaison agostique, liaison banane, liaison covalente de coordination (anciennement dative)…) dont l’étude ne sera pas faite ici.

Cet article est mis à disposition selon les termes de la Licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Pas de Modification 4.0 International.